青年科学工作者论坛2008年第1期
论著
瘦素抵抗肥胖大鼠脂肪组织SOCS-3、PPARγ及ACO mRNA水平的探讨
刘莉 顾海伦[1] 赵越 于飞 任亚浩 马爽 陈丽丽 杨军
中国医科大学公共卫生学院营养与食品卫生教研室,沈阳 110001
摘要:目的 观察高脂饮食诱导的肥胖瘦素抵抗大鼠细胞因子信号转导抑制因子-3(SOCS-3)、过氧化物酶体增殖物激活受体γ(PPARγ)及乙酰辅酶A氧化酶(ACO)mRNA表达水平的变化。方法 30只Wistar雄性大鼠,6只为对照组喂饲基础饲料,24只为高脂组喂饲高脂饲料,第8周末按体重增量从高脂组中筛选出8只大鼠作为肥胖组,测定对照组和肥胖组大鼠血清瘦素,附睾脂肪组织中SOCS-3,PPARγ以及ACO mRNA表达。结果 肥胖组大鼠体重以及血清瘦素水平均显著高于对照组(P<0.05);肥胖组脂肪组织SOCS-3、PPARγ mRNA水平显著高于对照组(P<0.05),而ACO mRNA则显著低于对照组(P<0.05)。结论 高脂饮食诱导的肥胖大鼠存在瘦素信号转导通路的抑制,脂肪酸氧化能力降低,脂肪合成能力增强。
关键词:肥胖 瘦素抵抗 信号转导抑制因子-3 过氧化物酶体增殖物激活受体γ 乙酰辅酶A氧化酶
中图分类号: 文献标识码:A
Study on SOCS-3, PPARγ and ACO mRNA expression of adipose tissues in obese rats with leptin resistance
LIU Li, GU Hailun, ZHAO Yue, YU Fei, et al.
School of Public Health, China Medical University, Shenyang 110001, China
Abstract: Objective To study the difference of suppressor of cytokine signaling 3(SOCS-3), peroxisome proliferators-activated receptor-γ(PPARγ) and acyl-CoA oxidase (ACO) mRNA expression in obese rats with leptin resistant induced by high-fat diet. Methods 6 Wistar male rats were fed with basic diet as control, and 24 rats were fed with high-fat diet as high-fat diet group. At the end of the 8th week, 8 obese rats were selected by body weight from high-fat diet group as obese group. Serum leptin, SOCS-3, PPARγ and ACO mRNA of epididymal adipose tissues were detected. Results Compare to control, body weight, serum leptin, SOCS-3 and PPARγ mRNA expression significantly increased in obese group, but ACO mRNA markedly decreased in obese group. Conclusion Obese rats induced by high-fat diet showed the suppression of leptin signaling transduction pathway, decreasing fatty acid oxidation and increasing fat synthesis.
Key words: obesity, leptin resistance, suppressor of cytokine signaling 3, peroxisome proliferators-activated receptor-γ(PPARγ), acyl-CoA oxidase (ACO)
目前肥胖的发病率正逐年增加,它是糖尿病、高血压、动脉硬化等慢性疾病的重要危险因素。肥胖的病因复杂,研究显示,大多数肥胖者和啮齿类动物存在明显的瘦素抵抗,而瘦素在中枢和外周的信号转导通路缺陷,形成瘦素信号转导抑制物的增多与瘦素抵抗的产生关系密切。本研究通过建立高脂饮食诱导的肥胖大鼠模型,检测血清瘦素水平,脂肪组织中细胞因子信号转导抑制因子-3(suppressor of cytokine signaling 3,SOCS-3),参与脂肪细胞分化及脂肪合成的过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor-γ,PPARγ)以及脂肪酸氧化相关酶-乙酰辅酶A氧化酶(acyl-CoA oxidase,ACO)在脂肪组织中的mRNA表达情况,探讨瘦素抵抗的肥胖大鼠中SOCS-3、PPARγ及ACO mRNA表达水平的变化。
1 材料与方法
1.1 动物来源
30只Wistar雄性大鼠,体重(150±10)g,购于中国医科大学实验动物中心。
1.2 试剂及试剂盒
大鼠瘦素ELISA试剂盒购于Biosource。PCR逆转录试剂盒购于TaKaRa大连宝生物公司, RNA提取采用天泽基因有限公司的RNAout, DNA Marker 采用TaKaRa的100bp DNA ladder
1.3 实验方法
1.3.1 动物实验方法 大鼠适应性喂养1周,然后按体重随机分为2组,对照组6只喂饲普通基础饲料,高脂组24只喂饲高脂饲料,高脂饲料含基础饲料73%、猪油20%、酪蛋白7%。大鼠单笼饲养,动物室温度(22±5)℃,相对湿度为(45±10)%,光照12h,自由摄取食物和水,共喂养8周,体重每周记录一次。第8周末,按体重增量大于对照组体重增量加上1倍标准差作为肥胖标准,从高脂组筛选出8只肥胖大鼠为肥胖组,其余高脂组大鼠剔除不用。处死前禁食12h,乙醚麻醉后,腹主动脉取血,静置后离心取上清,-20℃保存待测,随即取肾周、附睾、肠系膜脂肪垫称重,并立即将附睾脂肪垫放入液氮中,-80℃保存待测。
1.3.2 大鼠血清瘦素检测 按ELISA试剂盒说明书进行,每个样品做3个复孔,取平均值。
1.3.3 RT-PCR检测脂肪组织SOCS-3 mRNA、PPARγmRNA、ACO mRNA表达 用RNAout提取大鼠附睾脂肪组织总RNA。调每个样品的总RNA量为1μg。RT-PCR按照试剂盒使用方法:逆转录用15μl反应体系进行,其中包括3μl的总RNA、MgCl2 3μl、10´RT Buffer 1.5μl、RNase Free dH2O 4.125μl、dNTP(各10mmol/L)1.5μl、RNase Inhibitor 0.375μl、AMV Reverse Transcriptase 0.75μl、Random 9 mers 0.75μl。
PCR反应用2μl cDNA进行扩增(β-actin作为内参对照),加入10μl PCR反应体系中,包括5´PCR Buffer 2.5μl、灭菌蒸馏水7.16μl、TaKaRa Ex Taq HS 0.04μl、0.125μl上下游引物。方法如下:首先94℃预变性2min;PCR扩增35个循环包括94℃变性30s、53~56℃退火30s(温度因不同基因而异)、72℃延伸1min。2%琼脂糖电泳检测PCR产物。Fluorchem V2.0 Stand Alone系统检测PCR产物灰度值。PCR扩增上游和下游引物核酸序列见表1。
表1 PCR扩增上游和下游引物核酸序列
|
基因名称 |
上游引物5’-3’ |
下游引物5’-3’ |
|
SOCS-3 |
TCACCCACAGCAAGTTTCC |
GGATGCGTAGGTTCTTGGTC |
|
PPARγ |
TTGATTTCTCCAGCATTTC |
TTCAATCGGATGTTCTT |
|
ACO |
GCCCTCAGCTATGGTATTAC |
AGGAACTGCTCTCACAATGC |
|
β-actin |
TTGTAACCAACTGGGACGATATGG |
GATCTTGATCTTCATGGTGCTAGG |
1.4 统计分析
全部结果以均数±标准差表示,并采用SPSS13.0 软件进行统计分析。
2 结果
2.1 饲养期内对照组和肥胖组大鼠体重变化
给予高脂饲料前,对照组(185.83±5.74)g和肥胖组大鼠体重(184.13±13.38)g差异无显著性(P>0.05),但从第3周体重开始分化,到第4周末,喂饲高脂饲料的肥胖组大鼠体重显著高于对照组(P<0.05)。此后,肥胖组大鼠体重一直高于对照组,至第8周末,肥胖组大鼠体重达(413.13±70.5)g,显著高于对照组大鼠体重(332±54.74)g,且体重增量为(229±64.54)g,显著高于对照组大鼠体重增量(146.17±50.72)g (P<0.05) (图1)。
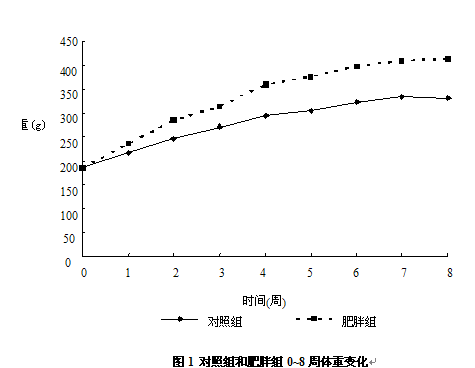
2.2 第8周末大鼠腹部脂肪储存状况和血清瘦素水平比较
实验结束时,肥胖组大鼠肠系膜、肾周、附睾脂肪组织重量、总脂肪均显著高于对照组,血清瘦素水平也显著高于对照组(表2)。
表2 对照组和肥胖组大鼠腹部脂肪储存状况和血清瘦素水平
Table 2 The abdomen fat and serum leptin level in control and obese group(`x±s)
|
组别 |
肠系膜
(g) |
肾周
(g) |
附睾
(g) |
总脂肪
(g) |
瘦素
(ng/ml) |
|
对照组 |
0.90±0.49 |
1.88±0.76 |
3.63±0.96 |
6.41±2.04 |
0.48±0.29 |
|
肥胖组 |
2.99±1.63(1) |
5.43±1.64(2) |
7.79±2.11(2) |
16.21±4.93(2) |
0.95±0.42(1) |
注:(1)与对照组比较 P<0.05,(2)与对照组比较P<0.01
2.3第8周末对照组和肥胖组大鼠SOCS-3,PPARγ、ACOmRNA表达情况
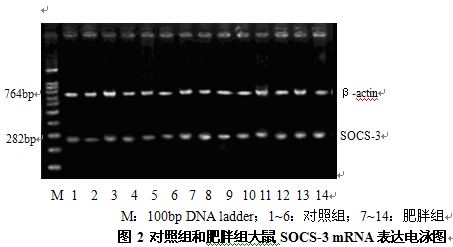
M:100bp DNA ladder;1~6:对照组;7~14:肥胖组
图2 对照组和肥胖组大鼠SOCS-3 mRNA表达电泳图
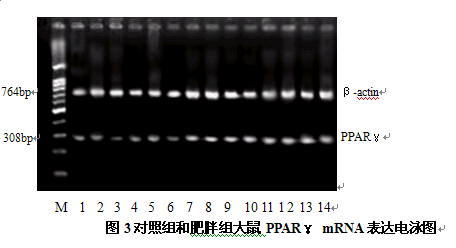
图3对照组和肥胖组大鼠PPARγ mRNA表达电泳图
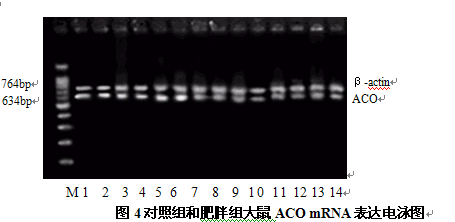
图4对照组和肥胖组大鼠ACO mRNA表达电泳图
表3 对照组和肥胖组大鼠SOCS-3、PPARγ、ACOmRNA灰度值分析
Table 3 SOCS-3,PPARγ and ACO mRNA level in control and obese group
|
组别 |
例数 |
SOCS-3 |
PPARγ |
ACO |
|
对照组 |
6 |
0.66±0.11 |
0.37±0.12 |
1.08±0.17 |
|
肥胖组 |
8 |
0.94±0.21(1) |
0.57±0.13(1) |
0.72±0.11(2) |
注:(1) 与对照组比较 P<0.05,(2) 与对照组比较 P<0.01
由图2、图3可见,肥胖组大鼠的SOCS-3 mRNA、PPARγ mRNA表达水平高于对照组,图4显示肥胖组大鼠的ACO mRNA表达水平低于对照组,灰度值分析结果显示其差异具有统计学显著性(P<0.05,P<0.01)。
3 讨论
瘦素抵抗是指体内存在高瘦素血症以及对瘦素减少体重的信号反应能力降低[1]。大多数肥胖的人和啮齿类动物存在瘦素抵抗现象,本实验采用高脂膳食成功诱导了Wistar肥胖大鼠模型,并通过检测血清瘦素水平,证实肥胖组大鼠存在瘦素抵抗,即肥胖组大鼠体重和脂肪垫重量显著高于对照组,而血清瘦素水平也显著高于对照组。瘦素抵抗的产生机制有多种,其中瘦素在中枢和外周的信号转导通路缺陷,形成瘦素信号的转导抑制物增多是产生瘦素抵抗的重要机制。SOCS-3是瘦素信号转导的负反馈抑制因子[2,3]。它可以由瘦素诱导产生,该过程需要Jak/STAT通路的参与,而诱导产生的SOCS-3通过与Jak结合而抑制了Jak的酪氨酸激酶活性及Jak诱导的瘦素受体的酪氨酸磷酸化,从而抑制了瘦素受体后的Jak/STAT信号转导通路。瘦素发挥调节体重的作用不仅通过下丘脑的瘦素受体,而且也通过与脂肪细胞的OB-Rb结合,激活Jak/STAT信号转导通路,对脂肪细胞发挥直接的自分泌或旁分泌作用,引起脂肪减少,体重降低[4,5]。本研究显示肥胖组大鼠脂肪组织SOCS-3 mRNA 表达显著高于对照组,提示高脂饮食诱导的肥胖大鼠存在外周瘦素信号转导通路的抑制。
同时我们检测了脂肪组织中PPARγ和ACO 的mRNA表达,结果显示肥胖组PPAPγ mRNA表达水平显著高于对照组,ACO mRNA水平则显著低于对照组。PPARγ是一类由配体激活的核转录因子,为核激素受体超家族中的成员,也是脂质活化的转录因子,在调节胰岛素作用、脂质代谢与糖代谢、脂肪细胞分化和能量平衡方面起重要的调节作用。PPARγ mRNA表达增加,会起到上调脂肪合成酶如乙酰辅酶A羧化酶、脂肪酸合成酶及甘油三磷酸转乙酰酶的作用,促进脂肪的合成。而ACO是脂肪细胞内与脂肪酸氧化相关的酶,肥胖大鼠该酶降低,提示肥胖大鼠存在瘦素抵抗的同时,脂肪组织内脂肪酸氧化能力也降低,促使脂肪细胞的脂肪储存进一步增加。
本研究显示高脂饮食诱导的肥胖大鼠血清瘦素水平增加,脂肪组织SOCS-3、ACO mRNA水平增加,而PPARγ mRNA水平降低,提示肥胖大鼠可能存在外周的瘦素抵抗,脂肪酸氧化能力降低,脂肪合成能力增强。但关于肥胖、瘦素抵抗及影响脂肪合成和分解的相关因子、酶类之间的内在作用机制,它们之间是否存在相互影响还需进一步探讨。
参考文献
1 EL-HASCHIMI K, PIERROZ D D, HILEMAN S M, et al. Two defects contribute to hypothalamic leptin resistance in mice with diet-induced obesity[J]. J Clin Invest, 2000,105(12):1827-1832.
2 BJORBAEK C, EL-HASCHIMI K, FRANTZ J D, et al. The role of SOCS-3 in leptin signaling and leptin resistance [J]. J Biol Chem, 1999,274(2):30059-30065.
3 MUNZBERG H, FLIER J S, BJORBAEK C. Region-specific leptin resistance within the hypothalamus of diet-induced obese mice [J]. Endocrinology, 2004,145(11):4880-4889.
4 MINOLOSHI Y, KIM Y B, PERONI O D, et al. Leptin stimulates fatty acid oxidation by activating AMP-activated protein kinase [J]. Nature, 2002,415(6869):339-343.
5 ATKINSON L L, FISCHER M A, LOPASCHUK G D. Leptin activates cardiac fatty acid oxidation independent of changes in the AMP-activated protein kinase: acetyl-CoA carboxylase-malonyl- CoA axis [J]. J Biol Chem, 2002,277(33):29424-29430.
收稿日期:2007-06-05
