青年科学工作者论坛2009年第5期
铁缺乏对大鼠维生素A代谢的影响
史锐,王朝旭1,蓝岚,韩巍,徐小磊,王克波,刘宝圣
哈尔滨医科大学公共卫生学院营养与食品卫生教研室,哈尔滨 150081
摘要:目的 研究铁缺乏对大鼠维生素A(VA)代谢的影响。 方法 44只雄性SD大鼠按体重随机分为4组,每组11只,Fe和VA正常对照组(Ⅰ组),Fe完全缺乏VA正常组(Ⅱ组),Fe轻度缺乏VA正常组(Ⅲ组),Fe和VA轻度缺乏组(IV组)。喂饲10周后处死,测定血清视黄醇、血清视黄醇结合蛋白(Retinol-binding protein ,RBP)、血红蛋白(Hb)、血清铁、血清铁饱和度、肝脏VA含量,肝脏视黄基酯含量,并用逆转录-聚合酶链反应(RT-PCR)法检测各组大鼠肝脏视黄醇结合蛋白(RBP)mRNA的表达。结果 与对照组相比,铁缺乏可以使血清视黄醇、肝脏VA含量显著降低(P < 0.05),使肝脏视黄基酯与肝脏VA的摩尔比值升高,使RBP含量有降低趋势,铁缺乏时肝脏视黄醇结合蛋白(RBP)mRNA表达显著降低。结论 铁缺乏可能通过影响维生素A吸收、储存、转运来影响体内维生素A的营养状况。
关键词:铁缺乏,维生素A代谢,大鼠
中图分类号: 文献标识码:
Effect of iron deficiency on vitamin A metabolism in rats
SHI Rui, WANG Chao-xu1,LAN Lan,et al. Department of Nutrition and Food Hygiene, College of Public Health, Harbin Medical University (Harbin 150081, China)
Abstract:Objective To study the effect of iron deficiency on vitamin A (VA) metabolism in rats. Methods Forty-four male SD rats were divided randomly into four groups according to their body weights and every group included 11 rats. They were normal iron and VA control group (Ⅰgroup), entire iron deficient and normal VA group (Ⅱgroup), slight iron deficient and normal VA group (Ⅲgroup)), slight iron and VA deficient(Ⅳgroup). After they were raised for ten weeks, the rats were sacrificed and the serum VA, retinol-binding protein(RBP),hemoglobin, serum iron, serum iron saturation, VA in the liver, retinyl ester in the liver were determined. Results iron deficiency decreased serum VA and VA in the liver significantly,and increased molar ratio of hepatic retinyl esters to retinol significantly. VA deficiency decreased the level of retinol-binding protion(RBP) mRNA expression in the liver significantly. Conclusion iron deficiency may affect VA nutritional status by influencing absorption, storage and transportation of VA.
Key words: Iron deficiency; Vitamin A metabolism; rat
缺铁性贫血(IDA)与维生素A缺乏曾被罗马营养会议(1992)和中国营养改善行动计划(1997)列为重点解决的健康问题,研究证实贫血和维生素A代谢之间存在一定的联系和相互作用[1] 。缺铁性贫血与维生素A缺乏往往同时存在,补铁能更有效地改善机体维生素A营养状况和免疫功能[2]。本文研究铁缺乏对大鼠维生素A营养状况的影响及铁缺乏对大鼠肝脏视黄醇结合蛋白(RBP)mRNA表达的影响,旨在为铁缺乏如何影响VA的代谢以及为防治铁和维生素A这两种营养素缺乏提供科学依据。
1材料与方法
1. 1 材料
维生素A标准品,视黄基酯标准品(美国Sigma公司);实验动物(上海斯莱克实验动物有限责任公司);血红蛋白试剂盒、血清铁试剂盒、血清总铁结合力试剂盒(南京建成生物工程研究所);血清视黄醇结合蛋白ELISA试剂盒(美国ADL公司)。mRNA检测试剂:总RNA提取试剂Trizol(美国Invitrogen公司),逆转录试剂盒(美国Promega公司),PCR试剂Easy Taq DNA Polymerase(北京全式金生物技术有限公司),引物(美国Promega公司)。
1.2 饲料配方
实验选用合成饲料,饲料配方参考了美国营养学会(American institue of nutrition)推荐的AIN-93G [3]啮齿类实验动物合成饲料配方,并对其进行适当调整,其中所含营养素和能量能保证大鼠生长发育的基本要求,其中混合无机盐中不加铁、混合维生素中不加维生素A,饲料配方见表1。
表1 饲料主要成分构成(g/kg)
Table 1 Composition of purified experimental (g/kg)
淀粉 无机盐 维生素
混合维生素(1000g): 维生素B1 600 mg; 维生素B2 600 mg; 维生素B6 700 mg; 尼克酸 3000mg; 泛酸 1600mg; 叶酸200 mg ; 维生素B12 250 mg; 生物素 75mg; 维生素E 5 000 IU;维生素K2 75mg; 维生素D3 200mg; 加蔗糖至1000g。
1.3 实验动物分组及饲养
清洁级雄性SD大鼠44只,21日龄,在实验室适应一周后,按体重随机分为4组,每组11只。各组饲料中铁和维生素A水平如下:Ⅰ组 Fe:35mg/kg 饲料,VA :1200μg/kg饲料;Ⅱ组 Fe:0mg/kg饲料 ,VA: 1200μg/kg饲料;Ⅲ组 Fe :15mg/kg饲料,VA :1200μg/kg饲料;Ⅳ组 Fe :15mg/kg饲料,VA :120μg/kg饲料。单笼喂养,所有动物均自由进食及饮用蒸馏水,温度19~25℃,湿度55% ~65% ,每日光照12 h,每天记录摄食量,并观察动物的一般状态,每周称体重1次,实验期为10周。实验结束后处死动物,腹主动脉采血,分离肝脏、脾脏。
1.4 检测指标
血清视黄醇、肝脏维生素A、肝脏视黄基酯测定采用高效液相色谱法[4,5];血清铁测定采用比色法;血红蛋白测定采用氰化高铁血红蛋白法;血清视黄醇结合蛋白采用酶联免疫吸附法测定。
1.5 视黄醇结合蛋白(RBP)mRNA测定
逆转录-聚合酶链反应(RT-PCR)法。取各组动物肝脏同一部位,参照Trizol试剂盒说明书提取总RNA,并测定RNA浓度。取1μg总RNA逆转录合成cDNA第一链,取2μl逆转录体系的cDNA作为摸板,加引物25pmol、Taq聚合酶0.25μl及相应缓冲液于25μl体系内进行PCR扩增,内参照GAPDH。引物序列如下:RBP的上游引物5'-GGAAGATGCTGAGCAACGAG-3',下游引物 5'-TTGCAGGTCACACCCTCTGC-3';内参照GAPDH上游引物5'-CTCAACTACATGGTCTACATG-3',下游引物5'-TGGCATGGACTGTGGTCATGAG-3'。PCR条件为94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,RBP和GAPDH循环35个周期。PCR产物经2%琼脂糖凝胶电泳,电泳结果在凝胶图象分析系统上扫描,计算RBP产物的密度值与GAPDH的密度值之比。
1.6 统计分析
采用SPSS13.0统计软件处理数据,结果以均数±标准差( ±s )表示,四组间比较采用方差分析,组间两两比较采用SNK-q检验,以P < 0.05为差异具有统计学意义。
±s )表示,四组间比较采用方差分析,组间两两比较采用SNK-q检验,以P < 0.05为差异具有统计学意义。
2 结果
2.1 各组动物体重及摄食量情况(表2)
各组间的初始体重和终末体重均差异无统计学意义(P>0.05),实验期内各组动物的平均每日摄食量、饲料利用率差异也无统计学意义(P>0.05),说明本实验条件对大鼠体重及摄食量无不良影响,动物生长状况良好。
表2 各组大鼠体重及摄食量情况比较( ±s, n=11,g)
±s, n=11,g)
Table 2 The comparison of the rats′weights and food intake in each group( ±s, n=11,g)
±s, n=11,g)
Ⅱ组 92.07±10.53 323.37±44.55 231.30±40.46 14.77±1.66 28.46±2.11
Ⅲ组 93.12±10.16 344.24±32.76 251.72±34.68 15.80±1.21 28.20±3.21
Ⅳ组 94.01±10.26 337.47±36.70 243.75±34.35 15.35±1.27 28.15±3.08
2.2 各组动物血清铁、血红蛋白(Hb)、血清铁饱和度(表3)
Ⅱ组,Ⅲ组,Ⅳ组血清铁水平显著低于Ⅰ组(P < 0.05),而Ⅱ组,Ⅲ组,Ⅳ组血清铁水平差异无统计学意义(P >0.05)。各组动物血红蛋白,Ⅱ组与Ⅰ组比较,Ⅱ组显著低于Ⅰ组(P < 0.05),Ⅲ组,Ⅳ组较Ⅰ组有下降趋势,但差异无统计学意义(P >0.05)。对于血清铁饱和度,Ⅱ组、Ⅲ组、Ⅳ组血清铁饱和度显著低于Ⅰ组(P < 0.05),Ⅱ组,Ⅲ组,Ⅳ组之间差异无统计学意义(P >0.05)。可见,铁缺乏模型建立较成功。
表3 各组大鼠血清铁、Hb、血清铁饱和度水平比较( ±s, n=11)
±s, n=11)
Table 3 The comparison of the rats′serum iron,Hb,serum iron saturation in each group ( ±s, n=11)
±s, n=11)
Ⅱ组 1.16±0.47 a 97.01±15.68 a 25.32±12.19a
Ⅲ组 1.47±0.47 a 100.98±14.41 34.71±8.85 a
Ⅳ组 1.57±0.37 a 105.20±8.75 36.49±7.75 a
2.3 各组动物肝脏维生素A、肝脏视黄基酯、肝脏视黄基酯与肝脏维生素A摩尔比值(表4) Ⅱ组,Ⅲ组,Ⅳ组肝脏维生素A显著低于Ⅰ组(P < 0.05),Ⅱ组,Ⅲ组之间差异无统计学意义(P >0.05)。肝脏视黄基酯,Ⅳ组显著低于Ⅰ组、Ⅱ组与Ⅲ组(P < 0.05),Ⅰ组、Ⅱ组与Ⅲ组比较差异无统计学意义(P >0.05)。Ⅱ组,Ⅲ组肝脏视黄基酯与肝脏维生素A摩尔比值显著高于Ⅰ组(P < 0.05)。
表4各组大鼠肝脏VA、肝脏视黄基酯、肝脏视黄基酯与VA摩尔比值水平比较( ±s, n=11)
±s, n=11)
Table 4 The comparison of the rats′VA, retinyl ester,molar ratio of hepatic retinyl esters to retinol in the liver in each group ( ±s, n=11)
±s, n=11)
Ⅱ组 14.53±3.84a 42.46±18.04 4.59±5.96a
Ⅲ组 16.99±4.60a 49.96±26.01 6.43±4.10a
Ⅳ组 0.41±0.096abc 0.79±0.15abc 1.14±0.42bc
2.4 各组动物血清视黄醇、血清视黄醇结合蛋白(RBP)水平(表5)
Ⅱ组血清视黄醇显著低于Ⅰ组(P < 0.05),Ⅳ组与Ⅰ组、Ⅱ组,Ⅲ组之间差异有统计学意义(P< 0.05)。血清视黄醇结合蛋白,Ⅳ组与Ⅰ组、Ⅱ组,Ⅲ组比较差异有统计学意义(P < 0.05),Ⅱ组,Ⅲ组与Ⅰ组相比较差异无统计学意义(P >0.05),但有下降趋势。可见,铁缺乏可以降低血清视黄醇水平,有使血清视黄醇结合蛋白水平降低的趋势。
表5各组大鼠血清视黄醇、血清视黄醇结合蛋白水平比较( ±s, n=11)
±s, n=11)
Table 5 The comparison of the rats′serum VA, retinol-binding protein in each group ( ±s, n=11)
±s, n=11)
Ⅰ组 253.58±36.70 230.05±9.73
Ⅱ组 214.40±49.91a 174.12±12.17
Ⅲ组 237.33±45.21 198.96±14.31
注:与Ⅰ组相比,a P < 0.05 ;与Ⅱ组相比,b P < 0.05 ;与Ⅲ组相比,c P < 0.05
2. 5各组大鼠肝脏视黄醇结合蛋白mRNA表达情况(图1)
Ⅰ组视黄醇结合蛋白mRNA的表达最强,同时从Ⅱ组、Ⅲ组和Ⅳ组可以看出,视黄醇结合蛋白mRNA表达随着铁缺乏而减弱。可见,铁缺乏可以使大鼠肝脏视黄醇结合蛋白mRNA的表达减弱。
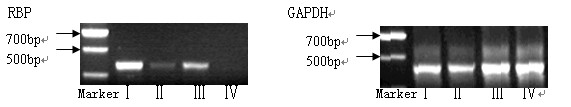
图1 大鼠肝脏视黄醇结合蛋白mRNA的表达
Figure 1 RBP mRNA expression levels in different group
3.讨论
铁缺乏与维生素A缺乏是两大主要的营养素缺乏,这两种营养素缺乏往往同时发生,二者的发生均与社会经济因素有一定关系,但当去除社会经济的影响后,二者仍表现出显著的相关性[6]。所以研究铁与维生素A在贫血中的相互作用对于改善世界各国尤其是发展中国家铁缺乏和维生素A缺乏的状况是十分有益的。
目前认为铁缺乏影响维生素A代谢可能的机制是:铁缺乏导致贫血,由于自身的保护机制,使肝脏中维生素A的储存形式增加,贫血的进一步发展,使维生素A在肝脏中的代谢受到破坏,从而使血清视黄醇减少[7]。
正常情况下,大鼠肝脏中储备一定量的铁,因此铁缺乏到铁严重缺乏是一个渐进的过程,本实验中铁缺乏没有对大鼠体重和摄食量产生影响,这可能是铁还没有达到严重缺乏的程度,铁缺乏时并不是首先影响体重和生长。铁缺乏引起血清视黄醇、肝脏视黄醇含量下降,血清视黄醇结合蛋白有降低趋势,肝脏视黄基酯与视黄醇摩尔比值升高,提示铁缺乏可通过影响维生素A吸收、储存、转运来影响体内维生素A的营养状况,原因可能是铁缺乏使肝脏视黄基酯的水解反应减少或者是增加了肝脏视黄醇的酯化反应,导致肝脏中视黄醇和视黄基酯的平衡被打破,从而使得可供机体利用的维生素A的活性物质视黄醇减少,而储存形式视黄基酯增加。
在视黄醇转运中,视黄醇结合蛋白是转运视黄醇从肝脏到周围组织的运转工具[8];在血浆转运视黄醇过程中,RBP防止其醇羟基被氧化,从而增加其在转运过程中的稳定性,同时对视黄醇的释放起调节作用[9]。本实验中,铁缺乏使得血清视黄醇结合蛋白含量有减少趋势,肝脏视黄醇结合蛋白 mRNA的表达减弱,降低了视黄醇结合蛋白的合成,视黄醇结合蛋白合成减少后,吸收入小肠上皮细胞的视黄醇不能有效的转运至体内,储存形式的视黄醇也不能有效地动用,需视黄醇组织不能得到充分的视黄醇进行生物合成。总之,铁可能促进维生素A的吸收和转运,对于改善维生素A的营养状况具有良好的作用,这些作用与铁能促进视黄醇结合蛋白合成有关。
视黄醇结合蛋白是维生素A的特异性运载蛋白,它在介导维生素A及其代谢物生理功能的正常发挥中具有不可替代的重要作用。铁缺乏对RBP影响的研究对于深入了解机体对维生素A的摄取,利用的分子机制,揭开了新的一页。而铁缺乏对视黄醇结合蛋白基因影响的研究,更将其功能由运载蛋白拓展到基因分子层面,在缺铁性贫血中,RBP的作用机制如何,将是今后一个研究热点。
参考文献
1. 李剑虹,朴建华,郭宁,等. 儿童维生素A与铁营养状况的相关性研究[J].卫生研究,2006,35(2):182-184.
2. Strube YN, Beard JL, Ross AC. Iron deficiency and marginal vitamin A deficiency affect growth, hematological indices and the regulation of iron metabolism genes in rats. J Nutr,
2002,132:3607–3615.
3. Philip G, Reeves, Forrest H, et al . AIN-93 purified diets for laboratory rodents : final report of the American Institute of Nutrition Ad Hoc writing committee on the reformulation of the AIN-76A rodent diet. J. Nutr,1993,1939-1951.
4. 王增寿,陈慧,张慧,等.HPLC法测定人血清中维生素A浓度[J].中国临床药学杂志,2005,14(6):382-383
5. 许青,李石,贺平,等.大鼠肝脏视黄醇含量的反相高效液相色谱检测[J].中华预防医学杂志,1998,32 (2) :112-113.
6. Graham JM, Haskell MJ, Pandey P. Supplementation with iron and riboflavin enhances dark adaptation response to vitamin A-fortified rice in iron-deficient , pregnant, night blind Nepali women. Am J Clin Nutr ,2007,85:1375–1384.
7. FRANCISCO J, JING-TSZ, DOMINGO J, et al. Iron deficiency in young rats alters the distribution of vitamin A between hepatic retinol and retinol esters. J Nutr,1999,129:1223-1228.
8. 梁学颖,徐琪寿.视黄醇结合蛋白的分子生物学[J].生理科学进展,2000,31(3):277-279.
9. Devirgiliis C, Gaetani S, Apreda M. Glycosylation is essential for translocation of retinol-binding protein across the endoplasmic reticulum membrane [J].Biochem Biophys Res Commun,2005,332(2):504-511.
